Part11、ER/ES指針
FDA 21 CFR Part11
Part11は、米国食品医薬品局(FDA)により施行された電子記録と電子署名に関する規則で、紙への記録を電子媒体へ書き換えるときの要求事項が1997年に制定されています。
Part11の条文は32ページの前文と約3ページの本文からなり、本文は次の3部構成になっています。
Part11の条文は32ページの前文と約3ページの本文からなり、本文は次の3部構成になっています。
(1)総則
(2)電子記録
(3)電子署名
(2)電子記録
(3)電子署名
このPart11に適用することにより、電子記録・電子署名が紙の記録物・手書き署名と同等のものとして扱われることになりますが、法律的な表現であり具体的な要件には解釈が必要となります。装置やシステムとしての主な要件をまとめると以下の項目になります。
- コンピュータ化システムバリデーション
- セキュリティ
- アクセス制限(アクセス管理)
- 電子記録の真正性、見読性、複製、保護
- 電子署名の方式、管理
- 監査証跡(オーディットトレイル)
当社では2003年に医薬用モニタリングシステムとしてCISAS/EXでPart11対応版を発売後、グラフィックレコーダのKRシリーズ、無線ロガーのMD8000シリーズでもPart11対応製品を発売してまいりました。
2015年にはKRシリーズ、MD8000シリーズのPart11対応製品で計測された電子記録データを一元管理することができる電子記録管理パッケージソフトウェアCISAS/ERを発売し、さらに拡張性とコストパフォーマンスに優れたシステムを提供いたしております。コンピュータシステム、レコーダ、無線ロガーのいずれでもPart11対応が可能でありお客様の要求に幅広くお応えできます。
2015年にはKRシリーズ、MD8000シリーズのPart11対応製品で計測された電子記録データを一元管理することができる電子記録管理パッケージソフトウェアCISAS/ERを発売し、さらに拡張性とコストパフォーマンスに優れたシステムを提供いたしております。コンピュータシステム、レコーダ、無線ロガーのいずれでもPart11対応が可能でありお客様の要求に幅広くお応えできます。
ER/ES指針
2005年4月1日に、厚生労働省医薬食品局長通知として「医薬品等の承認または許可等に係る申請等における電磁的記録及び電子署名の利用について」が発出されました。一般的には厚生労働省ER/ES指針またはER/ESガイドラインと呼ばれています。電磁的記録は日本の法的な用語からきており電子記録のことです。適用範囲や電子署名などでPart11との違いがあるものの基本的内容はPart11に準拠しており、日本版Part11と呼ばれることもあります。
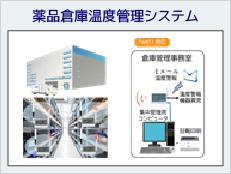
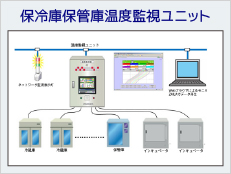
Part11対応システム例
Part11対応製品
1台のパソコンで送信器360台のデータを一元管理、イーサネット上に受信器を最大6台接続でき、各受信器は最大60台の送信器を接続可能
Part11対応のセキュリティ機能を持たせたアプリケーションソフトも用意
入力点数6点、12点のペーパレス記録計
小型ながら多彩な表示と高機能を有し、機器単体または小規模な監視装置として最適
CISASシリーズと組み合わせにより、コンピュータシステムとしての記録計として構築可能
入力点数最大48点 のペーパレス記録計
多彩な表示と高機能を有し、安定性試験機、冷蔵庫、冷凍庫等の機器のデータ管理に最適
CISASシリーズと組み合わせにより、コンピュータシステムとしての記録計として構築可能
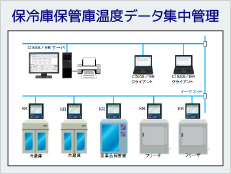
Part11に対応した無線ロガーやグラフィックレコーダで集録した計測データを電子記録として一元管理可能
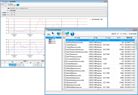
データ閲覧によるグラフ表示、日報・月報・レポートの作成(印刷、PDF出力)・電子署名可能